Pytanie, czym jest elektroliza, jest omawiane od czasów szkolnego kursu fizyki i dla większości ludzi nie jest tajemnicą. Inną kwestią jest jego znaczenie i praktyczne zastosowanie. Proces ten jest wykorzystywany w różnych gałęziach przemysłu i może być przydatny dla domowych majsterkowiczów.
Spis treści
Co to jest elektroliza?
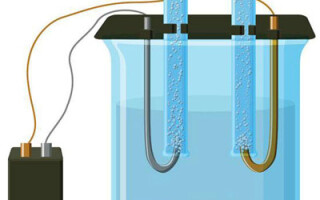
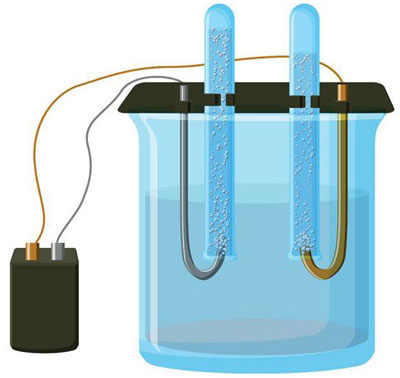
Elektroliza to zespół specyficznych procesów zachodzących w układzie elektroda-elektrolit, przez który przepływa stały prąd elektryczny. Mechanizm działania opiera się na wytwarzaniu prądu jonowego. Elektrolit jest przewodnikiem typu 2 (przewodnictwo jonowe), w którym zachodzi dysocjacja elektrolityczna. Polega to na rozkładzie na jony o ładunku dodatnim (kacja) i ujemny (anion) opłata.
System elektrolizy musi zawierać element dodatni (anoda) i ujemny (katoda) elektrody. Gdy przyłożony jest stały prąd elektryczny, kationy poruszają się w kierunku katody, a aniony w kierunku anody. Kationy to głównie jony metali i wodór, a aniony to tlen i chlor. Na katodzie kationy uzyskują nadmiar elektronów, co umożliwia reakcję redukcji Men+ + ne → Me (gdzie n oznacza walencyjność metalu). Natomiast na anodzie elektrony są oddawane z anionu, gdzie zachodzi reakcja utleniania.
W ten sposób w układzie zapewniony jest proces redoks. Ważne jest jednak to, że proces ten wymaga energii. Prąd ten musi być dostarczany przez zewnętrzne źródło prądu.
Prawa Faradaya dotyczące elektrolizy
Wielki fizyk M. Faraday dzięki swoim badaniom nie tylko umożliwił zrozumienie istoty elektrolizy, ale także dokonał obliczeń niezbędnych do jej przeprowadzenia. W 1832 r. pojawiły się jego prawa, które łączyły główne parametry zachodzących procesów.
Pierwsze prawo
Pierwsze prawo Faradaya mówi, że masa materii zredukowanej na anodzie jest wprost proporcjonalna do ładunku elektrycznego indukowanego w elektrolicie: m = kq = k*I*t, gdzie q to ładunek, k to współczynnik lub równoważnik elektrochemiczny substancji, I to natężenie prądu płynącego przez elektrolit, t to czas przepływu prądu.

Prawo drugie
Drugie prawo Faradaya umożliwiło wyznaczenie współczynnika proporcjonalności k. Brzmi on następująco: równoważnik elektrochemiczny dowolnej substancji jest wprost proporcjonalny do jej masy molowej i odwrotnie proporcjonalny do jej walencyjności. Prawo to jest wyrażone w postaci:

k = 1/F*A/zgdzie F to stała Faradaya, A to masa molowa substancji, z to jej walencja chemiczna.
Biorąc pod uwagę oba prawa, możemy wyprowadzić ostateczny wzór na obliczenie masy substancji osadzonej na elektrodzie: m = A*I*t/(n*F)gdzie n oznacza liczbę elektronów biorących udział w elektrolizie. Zazwyczaj n odpowiada ładunkowi jonu. Z praktycznego punktu widzenia ważne jest powiązanie masy substancji z przyłożonym prądem, co umożliwia sterowanie procesem poprzez zmianę jego natężenia.
Elektroliza stopów
Jedną z odmian elektrolizy jest wykorzystanie stopionego metalu jako elektrolitu. W tym przypadku w procesie elektrolitycznym biorą udział tylko jony stopu. Klasycznym przykładem jest elektroliza stopionej soli NaCl (sól kuchenna). Ujemne jony pędzą w kierunku anody, co oznacza, że uwalniany jest gaz (Cl). Na katodzie nastąpi redukcja metalu, czyli osadzenie się czystego Na, powstałego z jonów dodatnich, które przyciągnęły nadmiar elektronów. W podobny sposób można wytwarzać inne metale (K, Ca, Li itd.) z rozpuszczenia odpowiednich soli.
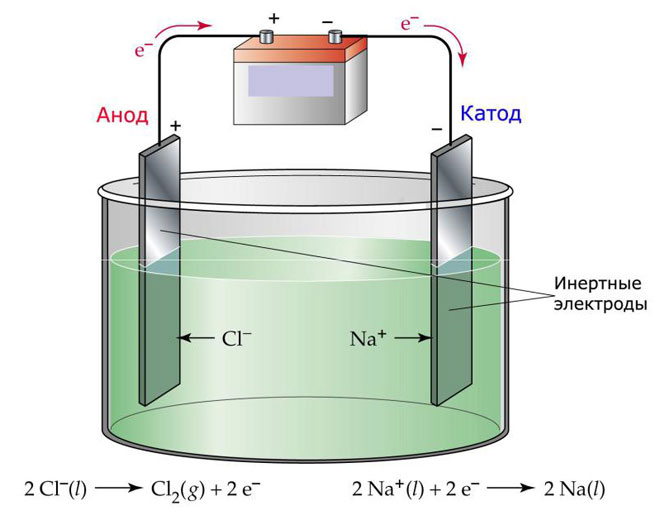
W elektrolizie stopionej elektrody nie ulegają rozpuszczeniu, a jedynie pełnią rolę źródła prądu. Do ich produkcji mogą być stosowane metale, grafit i niektóre półprzewodniki. Ważne jest, aby materiał miał odpowiednią przewodność. Jednym z najczęściej stosowanych materiałów jest miedź.
Właściwości elektrolizy w roztworach
Elektroliza w roztworze wodnym jest zupełnie inna niż elektroliza w stopie. W tym przypadku zachodzą 3 konkurujące ze sobą procesy: utlenianie wody z wydzieleniem tlenu, utlenianie anionu i anodowe rozpuszczanie metalu. W procesie tym biorą udział jony wody, elektrolit i anoda. W związku z tym redukcja wodoru, kationów elektrolitu i metalu anodowego może odbywać się w katodzie.

Możliwość wystąpienia tych konkurujących ze sobą procesów zależy od potencjału elektrycznego układu. Zachodzi tylko ten proces, który wymaga mniejszej ilości energii zewnętrznej. Dlatego kationy o najwyższym potencjale elektrodowym będą redukowane na katodzie, a aniony o najniższym potencjale będą utleniane na anodzie. Potencjał elektrodowy wodoru przyjmuje się jako "0". Na przykład w przypadku potasu jest to wartość (-2,93 В), sodu - (-2,71 В), ołowiu (-0,13 В), a dla srebra jest to (+0,8 В).
Elektroliza w gazach
Gaz może działać jak elektrolit tylko wtedy, gdy obecny jest jonizator. W tym przypadku prąd przepływa przez zjonizowane medium, wywołując niezbędne procesy na elektrodach. Prawa Faradaya nie mają zastosowania do elektrolizy gazu. Takie warunki są niezbędne do jego realizacji:
- Bez sztucznej jonizacji gazu nie pomoże ani wysokie napięcie, ani wysokie natężenie prądu.
- Do elektrolizy nadają się tylko kwasy gazowe pozbawione tlenu i niektóre gazy.
Ważne! Proces będzie przebiegał podobnie jak elektroliza w ciekłym elektrolicie, jeśli spełnione zostaną niezbędne warunki.
Właściwości procesów zachodzących na katodzie i anodzie
Dla praktycznego zastosowania elektrolizy ważne jest zrozumienie, co dzieje się na obu elektrodach, gdy przyłożony jest prąd elektryczny. Charakterystyczne są następujące procesy:
- Katoda. Dodatnio naładowane jony pędzą w jego kierunku. W tym miejscu następuje redukcja metali lub uwalnianie wodoru. Ze względu na ich aktywność kationową można wyróżnić kilka kategorii metali. Metale takie jak Li, K, Ba, St, Ca, Na, Mg, Be, Al są dobrze redukowane tylko ze stopionych soli. W przypadku stosowania roztworu wodór jest uwalniany w procesie elektrolizy wody. Następujące metale mogą być odzyskiwane w roztworze, ale przy odpowiednim stężeniu kationów - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Proces ten jest najłatwiejszy dla Ag, Cu, Bi, Pt, Au, Hg.
- Anoda. Do tej elektrody doprowadzane są jony naładowane ujemnie. Utleniając się, odbierają elektrony od metalu, co prowadzi do ich anodowego rozpuszczenia, tj. Aniony są przekształcane w dodatnio naładowane jony, które są kierowane w stronę katody. Aniony są również podzielone według ich aktywności. Z roztopów można usunąć tylko aniony PO4, CO3, SO4, NO3, NO2, ClO4, F. W roztworach wodnych nie są one poddawane elektrolizie, lecz działaniu wody z wydzieleniem tlenu. Do najłatwiej reagujących anionów należą OH, Cl, I, S i Br.

Podczas przeprowadzania elektrolizy należy wziąć pod uwagę skłonność materiału elektrody do utleniania się. Rozróżnia się anody obojętne i aktywne. Elektrody obojętne są wykonane z grafitu, węgla lub platyny i nie biorą udziału w dostarczaniu jonów.
Czynniki wpływające na proces elektrolizy
Proces elektrolizy zależy od następujących czynników
- Skład elektrolitu. Znaczący wpływ wywierają różne zanieczyszczenia. Dzielą się one na trzy rodzaje - kationy, aniony i substancje organiczne. Substancje te mogą być mniej lub bardziej ujemne niż metal podstawowy, co zakłóca proces. Wśród zanieczyszczeń organicznych znajdują się substancje zanieczyszczające (np. oleje) i środki powierzchniowo czynne. Ich stężenia są na poziomie maksymalnych dopuszczalnych wartości.
- Gęstość prądu. Zgodnie z prawem Faradaya, masa osadzonej substancji rośnie wraz z natężeniem prądu. Pojawiają się jednak niekorzystne okoliczności - skoncentrowana polaryzacja, podwyższone napięcie, intensywne ogrzewanie elektrolitu. W związku z tym w każdym przypadku istnieją optymalne wartości gęstości prądu.
- pH elektrolitu. Kwasowość medium jest również dobierana z myślą o metalach. Na przykład optymalne pH dla cynku wynosi 140g/cc.
- Temperatura elektrolitu. Ma to niejednoznaczny skutek. Wraz ze wzrostem temperatury wzrasta szybkość elektrolizy, ale wzrasta też aktywność zanieczyszczeń. Dla każdego procesu istnieje optymalna temperatura. Zazwyczaj wynosi ona od 38 do 45 stopni.
Ważne! Elektroliza może być przyspieszona lub spowolniona przez różne czynniki oraz wybór składu elektrolitu. Dla każdego zastosowania obowiązują inne zasady, których należy ściśle przestrzegać.
Gdzie stosowana jest elektroliza?
Elektroliza jest wykorzystywana w wielu zastosowaniach. Istnieje kilka głównych zastosowań, które można wyróżnić ze względu na wyniki praktyczne.
Galwanizacja
Cienka, wytrzymała powłoka galwaniczna może być nakładana metodą elektrolizy. Powleczony przedmiot umieszcza się w wannie jako katodę, a elektrolit zawiera sól pożądanego metalu. W ten sposób można pokryć stal cynkiem, chromem lub cyną.

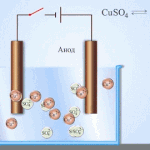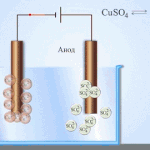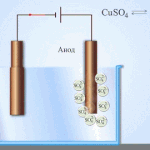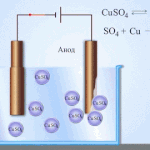
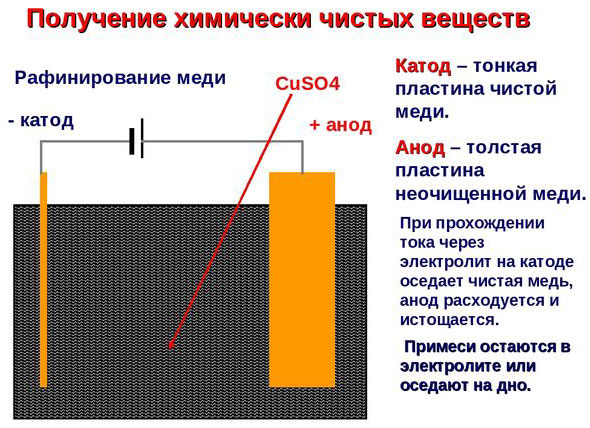
Elektrorafinacja - rafinacja miedzi
Przykładem procesu elektrotreatingu może być katoda - czysta miedź anoda - miedź z zanieczyszczeniami, elektrolit - wodny roztwór siarczanu miedzi. Miedź z anody przekształca się w jony i bez żadnych zanieczyszczeń osadza się w katodzie.
Wydobywanie metali
Aby wyodrębnić metale z soli, są one topione, a następnie poddawane elektrolizie w stopionym metalu. Proces ten jest dość skuteczny w odzyskiwaniu aluminium z boksytu, sodu i potasu.

Anodowanie
W tym procesie powłoka jest wytwarzana ze związków niemetalicznych. Klasycznym przykładem jest anodowanie aluminium. Część aluminiowa jest zamontowana jak anoda. Elektrolitem jest roztwór kwasu siarkowego. W wyniku elektrolizy na anodzie osadza się warstwa tlenku glinu, który ma właściwości ochronne i dekoracyjne. Powyższe technologie są szeroko stosowane w różnych gałęziach przemysłu. Procesy te można również przeprowadzać własnoręcznie i w bezpieczny sposób.
Koszty energii
Elektroliza wymaga dużej ilości energii. Proces ten będzie miał wartość praktyczną, jeśli prąd anodowy będzie wystarczający, co wymaga przyłożenia znacznego prądu stałego ze źródła zasilania. Ponadto powstają uboczne straty napięcia - przepięcia anodowe i katodowe - oraz straty w elektrolicie wynikające z jego oporności. Sprawność instalacji określa się, odnosząc moc pobieranej energii do jednostki masy użytecznej uzyskanej substancji.
Elektroliza jest od dawna stosowana w przemyśle z dużą wydajnością. Anodowanie i galwanizacja stały się powszechne w życiu codziennym, a wydobycie i obróbka materiałów pomaga w pozyskiwaniu wielu metali z rud. Proces ten można zaplanować i obliczyć, znając jego podstawowe schematy.
Powiązane artykuły: